Białka, proteiny- nie ważne jak
nazwiemy te wielkocząsteczkowe biopolimery. Są to majstersztyki natury. I to
nie jest przenośnia- to dosłownie mikromonumenty, które zachwycają pod każdym
względem w jaki możemy na nie patrzeć. Były na Ziemi na długo przed nami i
zapewne będę na długo i po Nas. Właściwie bez nic życie w formie jaką znamy nie
byłoby możliwe.
Z technicznego punktu widzenia białka, to
wielkie (z kilkoma wyjątkami) struktury chemiczne, które zbudowane są z zestawu
dwudziestu aminokwasów. Aminokwasy te tworzą białko, ponieważ połączone są ze
sobą wiązaniami peptydowymi. Zawiało chemią?- może trochę. Wyjaśnijmy to sobie
teraz na „chłopski rozum”, aby lepiej zrozumieć to o czym chciałbym pomówić w
tym artykule.
Co to aminokwas? Są to pewne
związki chemiczne o specyficznej, stosunkowo prostej budowie. Każdy szanujący
się aminokwas musi posiadać- grupę aminową (czyli atom azotu, który połączony
jest z dwoma atomami wodoru); grupa aminowa musi być połączona z atomem węgla,
zwanym węglem „alfa” do którego z drugiej strony przyczepiona jest grupa
karboksylowa (czyli atom węgla połączony z jednym atomem tlenu wiązaniem
podwójnym, a z drugim atomem tlenu wiązaniem pojedynczym, gdzie tlen ten
przyłączony ma jeszcze wodór). Do węgla „alfa” przyłączony jest jeszcze atom
wodoru i na schemacie ugrupowanie „R”. Ugrupowanie „R” nie jest jakimś
egzotycznym ugrupowaniem- to ogólne oznaczenie na wszystkie struktury jakie
mogą być w tym miejscu przyłączone. Może tam znaleźć się inny atom wodoru, może
znaleźć się atom węgla grupy metylowej, może znaleźć się atom węgla połączony
dalej z grupą hydroksylową. Obojętnie co tam jest przyłączone, aminokwas jako
„podstawową strukturę” ma grupę aminową i grupę karboksylową przyłączoną do
węgla alfa- wyjątkiem jest prolina, ale darujmy sobie omawianie wyjątków.
Budowa aminokwasów jest
przedziwna. Z jednej strony posiada on grupę, która posiada w normalnych
warunkach w wodzie ładunek dodatni (grupa aminowa), a z drugiej strony posiada
on grupę, która w normalnych warunkach w wodzie posiada ładunek ujemny (grupa
karboksylowa). Dodatkowe ładunki może posiadać łańcuch boczny (nasze „R”). Dzięki
temu, w roztworze wodnym aminokwasy występują jako zwitterjony- czyli jony
obojnacze- mimo że posiadają dwa ładunki w swojej cząsteczce (na grupie
aminowej jest ładunek dodatni, a na karboksylowej ujemy), aminokwas jako taki
jest cząsteczką obojętną, bo jedna grupa „znosi” sumaryczny ładunek drugiej.
W cząsteczce białka, aminokwasy
łączą się ze sobą w długi łańcuch. Od tego jakie grupy boczne występują w takim
łańcuchu, zależą właściwości i kształt białka. Zależy to tylko od grup bocznych
(nasze „R”), ponieważ „trzon”, czy „podstawa” jest taka sama- są to wiązania
peptydowe.
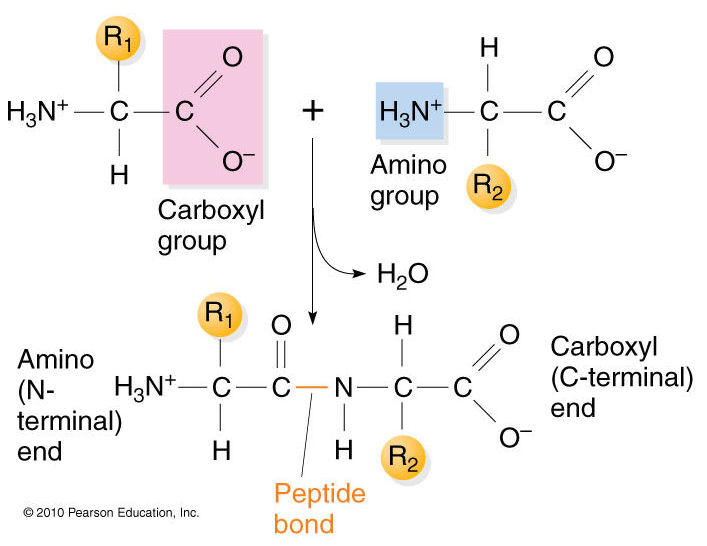
Wiązanie peptydowe jest równie
przedziwnym wiązaniem chemicznym, o fantastycznych właściwościach. Z punktu
widzenia chemii, jest to wiązanie amidowe. Powstaje ono pomiędzy dwoma
aminokwasami- a dokładniej między grupą karboksylową jednego, a grupą aminową
drugiego aminokwasu. W kontekście biochemii i chemii białek o wiązaniu amidowym
mówi się jako o wiązaniu peptydowym, ale to nazwa jednego i tego samego
wiązania. Darujemy sobie omawianie mechanizmu powstania wiązania peptydowego-
zostawmy to chemikom. Przyjrzyjmy się jego niezwykłe j strukturze.
Atom tlenu połączony wiązaniem
podwójnym do atomu węgla „dawnej” grupy karboksylowej, a ten atom węgla
połączony do atomu azoty „dawnej” grupy amidowej. Niesamowite możliwości! Z
teoretycznego punktu widzenia atom węgla grupy karboksylowej połączony jest z
atomem azotu wiązaniem pojedynczym. Gdyby tak było, możliwa byłaby rotacja
dookoła tego wiązania. Molekuły rotują- kręcą się dookoła wiązań pojedynczych.
Trochę to tak łopatki miksera- mikser to jedna część cząsteczki, a wirująca
łopatka zanurzona w np. bitej śmietanie to druga część. Prosty, metalowy
kawałek łączący łopatkę i mikser możemy wyobrazić sobie jako wiązanie, które
umożliwia obracanie się łopatki w cieśnie. Tak samo powinno być w wypadku
wiązania peptydowego- powinno się ono kręcić. Tak się jednak nie dzieje. Dzięki
unikalnemu połączeniu i „usadowieniu” atomu tlenu grupy karbonylowej i atomu
azotu dawnej grupy aminowej w tak bliskiej odległości, częściowo wiązanie
pojedyncze między atomem węgla a azotu, staje się wiązaniem podwójnym. I
rotacja w tym wypadku przestaje być możliwa. Wiązanie staje się płaskie jak
stół. Nie jest już możliwa jego rotacja wokół własnej osi.
Białka zbudowane są właśnie z
takich „elementów”, czyli aminokwasów, które połączone są płaskim i stosunkowo
trwałym wiązaniem peptydowym. Jest ono dość sztywne co powoduje, że białka jako
tako mogą utrzymać swój stały kształt. Zależy on oczywiście od obecności grup
pobocznych aminokwasów.
W roztworze wodnym, zsyntezowane
białko przypomina trochę unoszącą się nitkę z koralikami na niej, która może
się zwijać, skręcać, rozkręcać, obracać i przyjąć prawie każdy kształt. Fachowo
nazywa się to kłębkiem statycznym. Białko, aby mogło pełnić swoją funkcję nie
może oczywiście „wyglądać” jak mu się podoba. Zwija się ono bardzo szybko w
odpowiednią i ściśle zdefiniowaną strukturę. Każda cząsteczka pepsyny, czy
hemoglobiny, czy albuminy wygląda zawsze tak samo (pod warunkiem, że jest
prawidłowo zsyntezowana). Białko zwija się tak na skutek oddziaływania grup
bocznych ze środowiskiem, z samymi sobą, dzięki obecności mostków disiarczkowych i wielu innych czynników. Jest to poważny problem, nad którym
naukowcy cały czas pracują, aby móc w pełni go opisać.
Ponieważ naukowcy sami nie wiedzą
jak to się do końca dzieje, że białko przyjmuje w końcowym efekcie zawsze taki
sam kształt, my też nie będziemy się tym zajmowali. Przejdziemy do momentu,
kiedy mamy już gotowe, w pełni ukształtowane białko. Zakładamy, że ma ono taki
kształt jaki powinno posiadać, ewentualnie posiada on grupy prostetyczne (czyli
takie które pierwotnie nie należały do białka, ale przyłączyły się do niego w
określonym miejscu) i posiada zdolności katalityczne.
Nie każde białko oczywiście musi
posiadać grupę prostetyczną. Nie każde białko musi też brać udział w reakcjach
chemicznych w komórce. Niektóre białka odpowiadają tylko za transport
substancji (np. hemoglobina transportuje tlen), inne odpowiadają za budowę
struktur komórkowych (np. miozyna). Część białek bierze jednak udział w
katalizowaniu reakcji chemicznych.
Co to oznacza? Niektóre reakcje
chemiczne zachodzą bardzo szybko. Nie potrzebują one pomocy. Inne natomiast
zachodzą bardzo wolno- na tyle wolno, że organizm bez „wspomagania” nie mógłby
funkcjonować. Dzieje się tak dlatego, że w znakomitej większości przypadków do
zajścia reakcji, substraty muszą ułożyć się względem siebie w odpowiedniej
odległości. Muszą „obrócić” się do siebie jak najbardziej korzystnie. Ich
zderzenie musi być wymierzone z taką energią by mogła zajść reakcja- musi być
na tyle duża, że przy zderzeniu cząsteczki po prostu nie odskoczą od siebie.
Energia nie może być też zbyt duża by cząsteczki porozpadały się podczas
zderzenia.
Nie jest o to tak łatwo w gąszczu
wielu setek, a nawet tysięcy najróżniejszych cząsteczek. Białka, a dokładniej
enzymy- są to białka biorące udział w reakcjach- mają za zadanie „łapać”
cząsteczki, odpowiednio je względem siebie ustawiać, pomóc im w zderzeniu i
zajściu reakcji chemicznej, która normalnie zachodziłaby np. 1 raz na sekundę,
a w obecności białek zachodzi np. 10 tysięcy razy na sekundę.
Wiele osób twierdzi, że
najwspanialsza funkcją białka jest to, że ma możliwość „sterowania” reakcją
chemiczną. Bez wątpienia tak jest. Moim zdaniem jednak, tą „fajniejszą” cechą białek
jest fakt, że potrafią one „złapać” cząsteczki.
Zróbmy eksperyment. Połóż przed
sobą na stole długopis. Teraz za pomocą tylko jednego palca podnieś go i napisz
na kartce swoje imię. Możesz w tym celu użyć tylko i wyłącznie jednego palca-
aby złapać długopis i napisać swoje imię. Trudne? Chyba niemożliwe. Teraz
zaangażujemy w ten proces dwa palce. Pamiętaj, by nie opierać długopisu w
„zgłębieniu” między kciukiem, a palcem wskazującym. Spróbuj teraz napisać swoje
imię. Da się? Da, ale nie wygląda to najładniej. Teraz zrób to samo tak, jak robisz to zawsze- złap długopis tak
jak jest ci wygodnie.
Ilu palców i elementów ręki
użyłeś? Ja potrzebuję do tego kciuka, palca wskazującego i środkowego, oraz
wgłębienia między kciukiem i palcem wskazującym.
Enzymy działają tak samo. Muszą
one pochwycić cząsteczkę, która ma ulec reakcji w co najmniej trzech miejscach.
Zapewnia to stabilność w „trzymaniu” jej oraz możliwością jej dowolnego
obracania w przestrzeni. Oczywiście można zaangażować więcej niż 3 punktu podparcia,
ale 3 to minimum, by cząsteczka była pochwycona pewnie i na tyle stabilnie, by
przypadkiem nie wyślizgnąć się z objęć enzymu.
Czy jest to takie niesamowite?
Przecież co to za problem by chwycić cząsteczkę nawet w 3 miejscach. Wystarczy,
by element enzymu, który odpowiedzialny jest za złapanie cząsteczki miał
odpowiedni kształt i właściwości. My też przecież nie mamy problemu z
pochwyceniem długopisu, który leży sobie na biurku. Co w tym niesamowitego?
Wyobraź sobie teraz basen z wodą.
Wchodzisz do tego basenu i pływa w nim bardzo wiele ryb. Jedne mniejsze, drugie
większe, ale jest ich wiele i są z różnych gatunków (mają różny kształt,
pływają z różną szybkością, są spokojniejsze, lub bardziej wystraszone). Masz
za zadanie teraz pochwycić za pomocą jedynie 3 palców rybę w takim zbiorniku.
Oczywiście wszystkie pływają. Obijają się o ciebie. Jeśli byłaby tam duża ryba
np. rekin (oczywiście jeśli by cię nie zjadł) po uderzeniu w ciebie, zmieniłby
twoją trajektorię. Ty również w celu złapania tej jednej, konkretnej ryby
musisz machać rękami, nogami i wyginać się tak by po pierwsze zbliżyć się do
niej, a następnie złapać ją za pomocą trzech palców i najlepiej przysunąć jak
najbliżej ciała by nie uciekła.
Te porównanie jest bliższe prawdy
tego jak wygląda praca enzymu.
W roztworze wodnym w komórce mamy
setki substancji. Cząsteczka enzymu na ślepo przemierza wnętrze komórki i
„szuka swoim” cząsteczek. Cały czas jest bombardowana z różnych stron-
odpychana i przesuwana. A do tego, za pomocą małego swojego fragmentu musi
pochwycić inną cząsteczkę. Cząsteczka ta też się porusza, jej struktura wiruje
(tak jak już wcześniej mówiliśmy). Cząsteczka ta przepycha się między innymi,
zderza i „kręci się” jak niespokojne dziecko.
W momencie pochwycenia ją przez
enzym ten szybko zmienia swój kształt tak, by jak najmocniej pochwycić
cząsteczkę (czyli tak, by oddziaływania enzym- cząsteczka były jak
najsilniejsze) i stara się ją odizolować od środowiska na czas reakcji, aby
przypadkiem inna rozpędzona cząsteczka nie wybiła ją z uścisku. Enzym tak
dopasowuje się do kształtu cząsteczki, aby jak najsilniej ją złapać, ale
również tak, by móc nią manipulować w przestrzeni. Wszystko w nieustającym
ruchu wszystkich elementów, drganiu wszystkiego dookoła, ciągłych zderzeniach i
pląsaniach.
Trochę to tak, jakby próbować
utrzymać przerażoną żabę w rękach, siedząc podczas sztormu na bujającej się
tratwie na środku oceanu. A pamiętajmy, że enzymy robią to co ułamek sekundy,
zamieniając miliardy cząsteczek różnego rodzaju w inne cząsteczki w każdej
sekundzie naszego życia. Dla nas jest to abstrakcja, której nie możemy sobie
nawet wyobrazić- no bo jak coś takiego jak struktura białkowa w ciągu sekundy
potrafi np. tysiąc razy przyłączyć się do tysiąca różnych cząsteczek, jedna po
drugiej, dopasować się do tych cząsteczek, przeprowadzić na nich odpowiednią
reakcję, wypuścić je, związać się z kolejną i tak od setek to setek tysięcy
razy w ciągu sekundy. Dla nas jest to magia. Dla enzymów- chleb powszedni.
Zapraszam do odwiedzenia strony na Facebook!